염화 알루미늄
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
염화 알루미늄은 화학식 AlCl3를 갖는 알루미늄과 염소의 화합물로, 온도와 상태에 따라 다양한 구조를 가진다. 무수 염화 알루미늄은 루이스 산 촉매로 널리 사용되며, 프리델-크래프츠 반응과 같은 유기 화학 반응에 활용된다. 또한, 육수화물 형태는 다한증 치료에 사용되기도 한다. 염화 알루미늄은 흡입 시 호흡기 자극을 유발하며, 환경 규제 대상 물질이므로 취급에 주의해야 한다.
더 읽어볼만한 페이지
- 알루미늄 화합물 - Alq3
트리스(8-히드록시퀴놀리네이트)알루미늄(Alq₃)은 자오면 및 안면 이성질체와 여러 다형체를 가지며, 유기 발광 다이오드(OLED)의 전자 수송층 물질로 널리 쓰이고 퀴놀린 고리의 치환기 변화를 통해 발광 특성 조절이 가능하다. - 알루미늄 화합물 - 녹주석
녹주석은 육방정계에 속하는 규산염 광물로, 다양한 색상을 띠며 베릴륨 화합물로 알려져 채굴, 취급, 정제 시 폐렴을 유발할 수 있다. - 무기 화합물 - 산화 수은(II)
산화 수은(II)는 화학식 HgO를 갖는 수은의 산화물로, 350°C에서 수은을 가열하거나 질산수은(II)를 열분해하여 생성되며, 수은 생산, 수은 전지 음극 재료로 사용되지만 독성이 강하다. - 무기 화합물 - 염화 암모늄
염화 암모늄은 분자량 53.50의 흰색 결정성 고체 화합물로, 물에 잘 녹고 가열 시 암모니아와 염화 수소 기체로 분해되며, 비료, 전지 전해액, 융제, 의약품, 식품 첨가물 등 다양한 용도로 사용된다. - 금속 할로젠화물 - 염화 칼륨
염화칼륨(KCl)은 칼륨 이온과 염화물 이온으로 이루어진 이온성 화합물로, 칼륨 비료, 화학 공업, 의학, 사형 집행 등 다양한 용도로 사용되며, 면심입방구조와 광학적 특성을 지니고, 캐나다, 러시아, 벨라루스 등에서 주로 생산된다. - 금속 할로젠화물 - 염화 나트륨
염화 나트륨은 염화물 이온과 나트륨 이온으로 구성된 백색 고체 이온 결정으로, 짠맛을 내며 융점은 800.4℃이고, 다양한 용도로 사용되며 겨울철 제설에도 활용되는 정염의 일종이다.
2. 역사
18세기에 염화 알루미늄은 알루미나 염산염, 해양 명반, 점토질 해양 염[8], 염산 점토[9]로 알려졌다. 1830년대부터 화학적으로 연구되기 시작했다.[10]
3. 구조
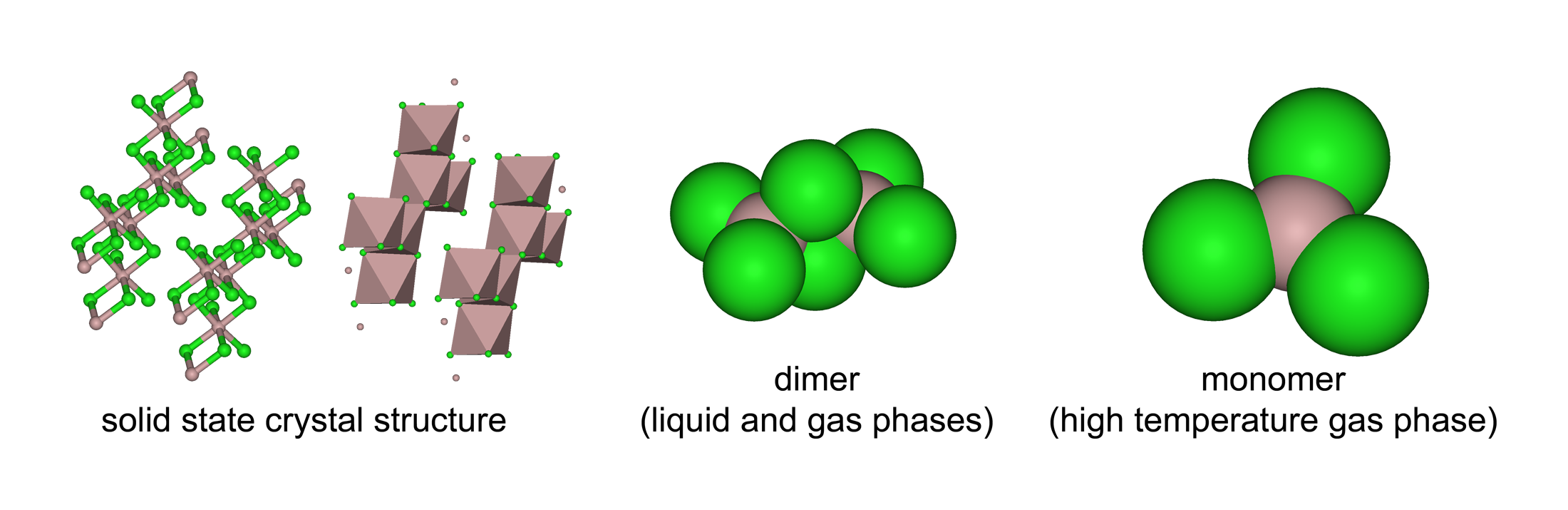
염화 알루미늄은 온도와 상태(고체, 액체, 기체)에 따라 다양한 구조를 갖는다. 고체 염화 알루미늄은 염화물 이온이 입방 최밀 충전된 시트형 층상 구조를 가지며, Al(알루미늄) 중심은 팔면체 배위 기하 구조를 나타낸다.[11] 염화 이트륨(III)도 이와 동일한 구조를 갖는다. 염화 알루미늄은 녹으면 이량체 형태로 존재하며, 사배위 알루미늄을 갖는다. 액체 상태의 밀도(1.78 g/cm3)가 고체 염화 알루미늄(2.48 g/cm3)보다 낮아 이러한 구조 변화가 나타난다. 염화 알루미늄 이량체는 증기상에서도 발견된다. 더 높은 온도에서는 이량체가 해리되어 와 구조적으로 유사한 삼각 평면 분자 구조의 단량체가 된다. 용융된 염화 알루미늄은 염화 나트륨과 같은 이온성 할로겐화물과 달리 전기 전도성이 낮다.[12]
염화 알루미늄 단량체는 단량체 형태에서 점군 D3h에 속하고, 이량체 형태에서는 D2h에 속한다.
알루미늄 이온은 물과의 친화성이 강해 격렬하게 가수 분해되어 염화 수소를 발생시킨다.[33]
:
:
이러한 특성으로 인해, 습한 공기 중에서는 흰 연기를 발생시킨다.
3. 1. 무수 염화 알루미늄
염화 알루미늄(AlCl3)은 온도와 상태(고체, 액체, 기체)에 따라 세 가지 구조를 갖는다. 고체 AlCl3는 입방 최밀 충전 염화물 이온을 갖는 시트형 층상 구조를 가지며, Al 중심은 팔면체 배위 기하 구조를 나타낸다.[11] 녹은 염화 알루미늄은 이량체 Al2Cl6로 존재하며, 사배위 알루미늄을 갖는다. 이러한 구조 변화는 액체(1.78 g/cm3)의 밀도가 고체 염화 알루미늄(2.48 g/cm3)보다 낮기 때문이다. Al2Cl6 이량체는 증기상에서도 발견된다. 더 높은 온도에서는 Al2Cl6 이량체가 해리되어 삼각 평면 AlCl3 단량체가 되는데, 이는 삼플루오린화 붕소(BF3)와 구조적으로 유사하다. 용융물은 이온성 할로겐화물인 염화 나트륨과는 달리 전기 전도성이 낮다.[12]
염화 알루미늄 단량체는 점군 D3h에 속하고, 이량체 형태에서는 D2h에 속한다.
녹는점이 170.9℃인 백색 고체로 중합체를 형성한다. 불순물을 포함하면 엷은 황색을 띤다. 액체 상태에서는 이량체를 형성하며, 전기 전도도가 낮은 등 알루미늄과 염소의 결합은 공유 결합성을 띤다.
160℃ 이상에서 승화하며, 기체는 이량체 Al2Cl6을 형성하고, 800℃ 이상에서 단량체가 된다.
3. 2. 염화 알루미늄 육수화물
육수화물은 팔면체 [Al(H2O)6]3+ 양이온 중심과 염화물 음이온(Cl-)을 반대 이온으로 구성한다. 수소 결합은 양이온과 음이온을 연결한다.[13]
알루미늄 염화물의 수화물 형태는 중심 알루미늄 이온이 6개의 물 리간드 분자로 둘러싸인 팔면체 분자 구조를 갖는다. 배위 포화 상태이기 때문에 수화물은 프리델-크래프츠 알킬화 및 관련 반응의 촉매로서 가치가 거의 없다. AlCl3 · 6H2O로 표시되는 화합물로, 알루미늄에 물 분자 6개가 배위된 착이온과 염화물 이온으로 구성된 이온성 물질이다. 물에 용해되면 부분적으로 수산화 알루미늄과 염산으로 가수 분해된다. 수용액을 가열해도 재결정되지 않고, 수산화 알루미늄이 석출된다.[32]
6수화물은 수산화 알루미늄을 염산에 녹이고, 염화 수소 가스를 도입하여 포화시키면 얻을 수 있다. 염석제, 목재 방부제, 염료, 사진의 정착제, 방취제 또는 의료용 방한제로 사용된다.
4. 생성
염화 알루미늄은 650°C에서 750°C 사이의 온도에서 알루미늄 금속과 염소 또는 염화 수소의 발열 반응을 통해 대규모로 제조된다.[12]
:2Al + 3Cl2 → 2 AlCl3
:2Al + 6HCl → 2 AlCl3 + 3H2
염화 알루미늄은 구리(II) 염화물과 알루미늄 사이의 단일 치환 반응을 통해서도 형성될 수 있다.
:2Al + 3CuCl2 → 2AlCl3 + 3Cu
수화된 삼염화 알루미늄은 염산에 알루미늄 산화물을 용해시켜 제조한다. 금속 알루미늄 또한 염산에 쉽게 녹아 수소 가스를 방출하고 상당한 열을 발생시킨다. 이 고체를 가열해도 무수 삼염화 알루미늄이 생성되지 않고, 육수화물은 가열 시 수산화 알루미늄으로 분해된다.[32]
:[Al(H2O)6]Cl3 → Al(OH)3 + 3HCl + 3H2O
금속 알루미늄에 직접 염소나 염화 수소를 작용시켜 제조한다.
5. 반응
무수 염화 알루미늄(AlCl3)은 강력한 루이스 산으로, 벤조페논 및 메시틸렌과 같이 약한 루이스 염기와도 루이스 산-염기 부착물을 형성할 수 있다.[27] 염화물 이온이 존재할 때 사염화알루민산염 ([AlCl4]-)을 형성한다.
칼슘 수소화물 및 마그네슘 수소화물과 테트라히드로푸란에서 반응하여 테트라히드로알루민산염을 생성한다.
무수 염화 알루미늄은 흡습성이 있어 물에 대한 친화력이 매우 강하다. 물과 반응하면 Cl- 리간드가 H2O 분자로 치환되어 육수화물 ([Al(H2O)6]Cl3)을 형성한다. 육수화물을 가열해도 무수 상태는 다시 얻을 수 없고, 대신 HCl이 손실되어 수산화 알루미늄 또는 알루미나(산화 알루미늄)가 남는다.
: [Al(H2O)6]Cl3 → Al(OH)3 + 3 HCl + 3 H2O
금속 아쿠오 착물과 마찬가지로, 수용액 AlCl3는 아쿠오 리간드의 이온화로 인해 산성을 띤다.
: [Al(H2O)6]3+ ⇌ [Al(OH)(H2O)5]2+ + H+
수용액은 수화된 Al3+ 이온을 포함하는 다른 알루미늄 염과 유사하게 반응하며, 묽은 수산화 나트륨과 반응하면 젤라틴상의 침전인 수산화 알루미늄을 생성한다.
: AlCl3 + 3 NaOH → Al(OH)3 + 3 NaCl
알루미늄 이온은 물과의 친화성이 강하여 격렬하게 가수 분해하여 염화 수소를 발생시킨다.[33]
:
:
6. 용도
염화 알루미늄은 다양한 분야에서 널리 사용된다.
- 화학 반응 촉매: 염화 알루미늄은 프리델-크래프츠 반응과 같은 아실화 및 알킬화 반응에서 루이스 산 촉매로 사용된다. 세제와 에틸벤젠 생산에 사용되며, 벤젠과 포스겐으로부터 안트라퀴논을 제조하는 데에도 사용된다.[12] 가터만-코흐 반응을 통해 방향족 고리에 알데히드기를 도입하는 데 사용될 수 있으며, 일산화 탄소, 염화 수소, 염화 구리(I) 공촉매가 필요하다.[18] 또한, 엔 반응을 촉매하거나,[20] 탄화수소 결합 및 재배열을 유도하는 데 사용된다.[21][22]
- 의료: 염화 알루미늄 육수화물은 다한증(과도한 땀) 치료에 사용된다.[24][25][26] 백신의 효과를 강화하기 위한 보조제로도 사용되며, 디프테리아 백신, DTaP 백신 등에 첨가된다.[40] 여드름 치료에도 사용될 수 있지만, 이에 대한 근거는 제한적이다.[41] 국소 다한증 치료에는 염화 알루미늄 수용액 외용이 적용된다.[42]
- 기타 용도: 염화 알루미늄 6수화물은 염석제, 목재 방부제, 염료, 사진 정착제, 방취제 또는 의료용 방한제로 사용된다.[32] 수산화 알루미늄을 염산에 용해하여 생성되는 폴리염화알루미늄은 상하수도 응집제로 사용된다.
6. 1. 화학 반응 촉매
염화 알루미늄()은 프리델-크래프츠 반응과 같은 아실화 및 알킬화 반응에서 일반적인 루이스 산 촉매로 사용된다. 세제와 에틸벤젠이 대표적인 생성물이다. 예를 들어, 벤젠과 포스겐으로부터 안트라퀴논(염료 산업에서 사용)을 제조하는 데 사용된다.[12] 일반적인 프리델-크래프츠 반응에서 아실 클로라이드 또는 알킬 할라이드는 다음과 같이 방향족 시스템과 반응한다.[27]
알킬화 반응은 아실화 반응보다 더 널리 사용되지만, 기술적으로 더 까다롭다. 두 반응 모두에서 염화 알루미늄뿐만 아니라 다른 물질과 장비도 건조해야 하지만, 반응이 진행되기 위해서는 미량의 수분이 필요하다.[14]
프리델-크래프츠 반응의 일반적인 문제는 염화 알루미늄 촉매가 때때로 완전한 화학량론적 양으로 필요하다는 것이다. 이는 염화 알루미늄이 생성물과 강하게 착물을 형성하기 때문이다. 이러한 복잡성으로 인해 종종 많은 양의 부식성 물질 폐기물이 발생한다. 이러한 이유와 유사한 이유로 염화 알루미늄의 사용은 종종 제올라이트로 대체되었다.[7]
염화 알루미늄은 또한 가터만-코흐 반응을 통해 방향족 고리에 알데히드기를 도입하는 데 사용될 수 있다. 이 반응은 일산화 탄소, 염화 수소 및 염화 구리(I) 공촉매를 사용한다.[18]
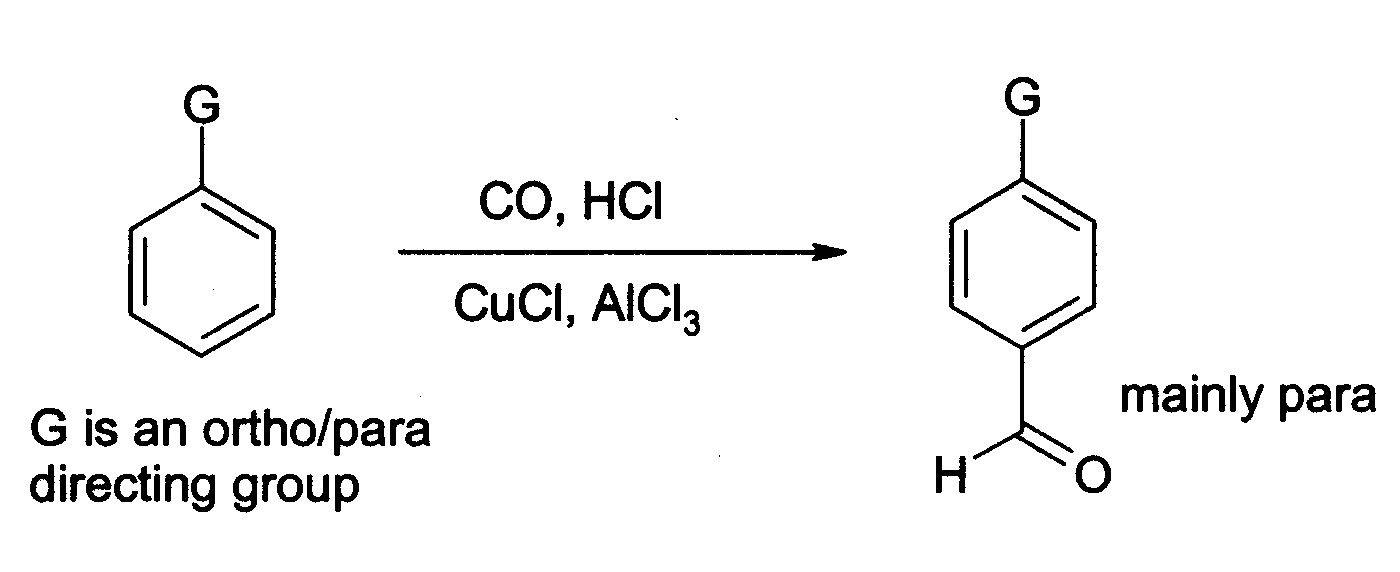
염화 알루미늄은 유기 화학에서 광범위한 다른 응용 분야를 가지고 있다.[19] 예를 들어, 3-부텐-2-온(메틸 비닐 케톤)을 카르본에 첨가하는 것과 같은 엔 반응을 촉매할 수 있다.[20]
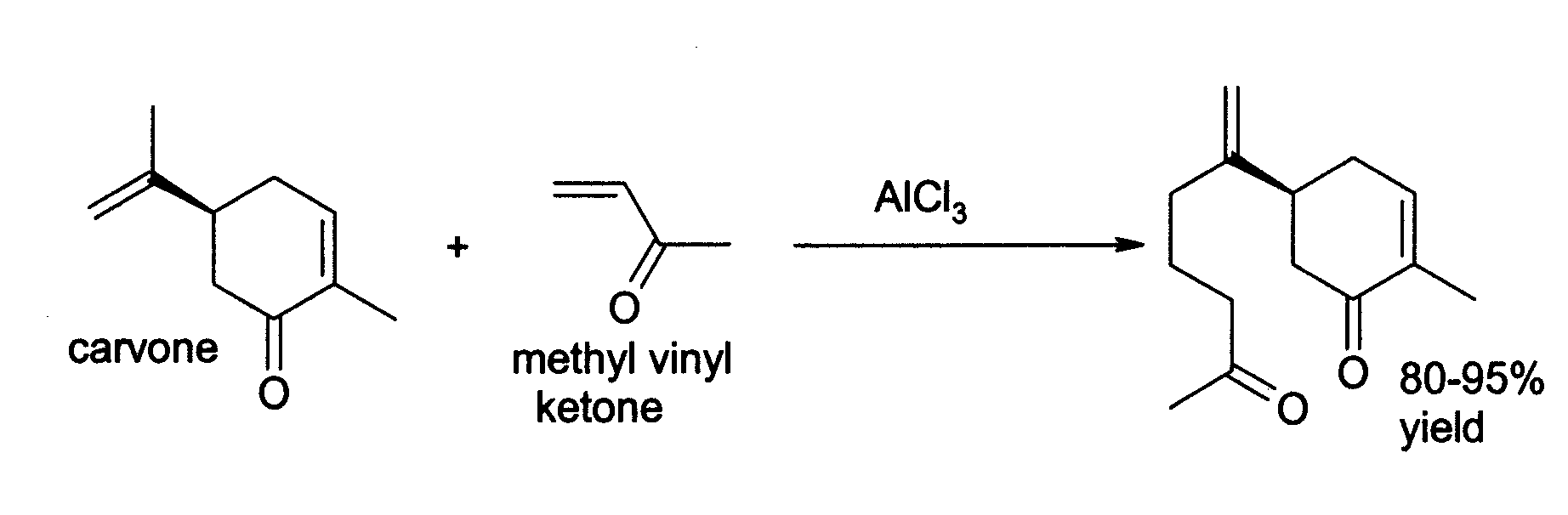
다양한 탄화수소 결합 및 재배열을 유도하는 데 사용된다.[21][22]
알루미늄과 결합된 염화 알루미늄은 아렌의 존재 하에서 특정 금속 할라이드로부터 피셔-하프너 합성을 통해 비스(벤젠)크롬과 같은 비스(아렌) 금속 착체를 합성하는 데 사용할 수 있다. 디클로로페닐포스핀은 염화 알루미늄을 촉매로 사용하여 벤젠과 삼염화 인의 반응에 의해 제조된다.[23]
6. 2. 의료
염화 알루미늄 육수화물은 다한증(과도한 땀) 치료에 사용된다.[24][25][26] 백신의 효과를 강화할 목적으로 첨가되며, 디프테리아 백신, DTaP 백신(DT 백신, 디프테리아·파상풍 혼합) 등에 보조제로 첨가되어 있다. 다른 백신에도 알루미늄 화합물이 첨가되는 경우가 많다. 알루미늄 화합물은 세계 최초의 보조제로 1926년에 인가되어 90년 이상의 역사를 가지고 있다.[40]WHO의 ATC 분류에서 여드름에 대한 국소 제제로 분류된다. 미국 피부과학회에서 발행한 여드름 치료 가이드라인 2016에 따르면 염화 알루미늄의 권장을 뒷받침할 수 있는 제한적인 근거가 있다.[41]
국소 다한증 치료의 첫 번째 선택으로, 염화 알루미늄 수용액의 외용이 적용된다. 염화 알루미늄이 각질층 내의 땀관과 결합하여 발한의 출구를 막는 작용을 하는 것으로 보인다.[42] 염화 알루미늄 용액은 병원에서 원내 제제로서 10~50% 용액이 처방되고 있다.[43]
6. 3. 기타 용도
염화 알루미늄 6수화물은 수산화 알루미늄을 염산에 녹이고, 염화 수소 기체를 도입하여 포화시켜 얻을 수 있다. 염석제, 목재 방부제, 염료, 사진 정착제, 방취제 또는 의료용 방한제로 사용된다.[32]수산화 알루미늄을 염산에 용해하면 염기성 염화 알루미늄 중합체(
7. 안전성
무수 염화 알루미늄(AlCl3)은 염기와 격렬하게 반응하므로 주의가 필요하다. 흡입하거나 접촉하면 눈, 피부, 호흡기에 자극을 줄 수 있다.[51][30]
염화 알루미늄은 신경독으로 확립되어 있다. 미세아교세포의 활성화를 억제하는 작용, 혈액-뇌 장벽(BBB)에서의 막 기능 변화 등이 보고되고 있다.[36][37][38][39]
8. 환경 규제
알루미늄 이온은 유해하며 어독성 및 식물 생육 저해 요인이 될 수 있으므로, 수도법에서는 알루미늄 농도를 0.1ppm 미만으로 유지하도록 수질 기준을 규정하고 있다.[34]
이 때문에 과도한 사용은 피하고 적절하게 이용해야 한다. 장시간 공기 중에 방치하면 산화되어 산화 알루미늄의 백색 결정이 석출될 수 있으므로 주의가 필요하다.[35]
참조
[1]
RubberBible92nd
[2]
웹사이트
Properties of substance: Aluminium chloride
http://chemister.ru/[...]
2007-03-19
[3]
학술지
Die Kristallstruktur der Aluminiumhalogenide II
[4]
RubberBible92nd
[5]
Sigma-Aldrich
2014-05-05
[6]
PGCH
[7]
Ullmann
Aluminum Compounds, Inorganic
[8]
서적
Elements of natural history, and of chemistry: being the second edition of the elementary lectures on those sciences ... enlarged and improved by the author ... Translated into English, with ... notes; and an historical preface by the translator W. Nicholson
https://books.google[...]
1790
[9]
서적
Elements of the Art of Dyeing ... Translated ... by William Hamilton
https://books.google[...]
Stephen Couchman; sold by J. Johnson
1791
[10]
서적
The American Journal of Science
https://books.google[...]
Kline Geology Laboratory, Yale University.
1835
[11]
서적
Structural Inorganic Chemistry
Oxford Press
1984
[12]
서적
Chemistry of the Elements
https://books.google[...]
"[[Pergamon Press]]"
[13]
학술지
Kristallhydrate II. Die Struktur von Chromchlorid- und Aluminiumchloridhexahydrat
[14]
학술지
Durch Aluminiumchlorid Katalysierte Reaktion, VI. Mitteil.: Die Umlagerung des Cyclohexans in Metyl-cyclopentan
1933
[15]
학술지
Synthesis of Trifluoromethyl Ketones from Carboxylic Acids: 4-(3,4-Dibromophenyl)-1,1,1-trifluoro-4-methylpentan-2-one
[16]
학술지
Preparation of 9,10-Dimethoxyphenanthrene and 3,6-Diacetyl-9,10-Dimethoxyphenanthrene
[17]
학술지
3-(4-Bromobenzoyl)propanoic Acid
[18]
서적
Organic Chemistry
"[[Prentice Hall]]"
2003
[19]
서적
Acidic and Basic Reagents
"[[John Wiley & Sons|Wiley]]"
1999
[20]
학술지
Lewis-acid catalyzed ene reactions
[21]
학술지
Highly Reactive Magnesium for the Preparation of Grignard Reagents: 1-Norbornanecarboxylic Acid
[22]
학술지
Hexamethyl Dewar Benzene
[23]
학술지
Phenyldichlorophosphine
[24]
학술지
Hyperhidrosis: Management Options
2018-06
[25]
학술지
The etiology, diagnosis, and management of hyperhidrosis: A comprehensive review: Therapeutic options
2019-09
[26]
웹사이트
Aluminum Chloride (Topical) (Monograph)
https://www.drugs.co[...]
drugs.com
[27]
서적
Friedel-Crafts and Related Reactions
Interscience
[28]
웹사이트
List of Minerals
https://www.ima-mine[...]
"[[International Mineralogical Association]]"
2011-03-21
[29]
웹사이트
Cadwaladerite
https://www.mindat.o[...]
[30]
웹사이트
Aluminium Chloride
https://web.archive.[...]
solvaychemicals.us
[31]
웹사이트
統計表一覧(経済産業省生産動態統計)
https://www.meti.go.[...]
経済産業省
[32]
서적
日本大百科全書(ニッポニカ)
小学館
[33]
학술지
アルミニウムの化学 : 有機合成反応における利用(身近な元素の世界)
https://doi.org/10.2[...]
日本化学会
2013
[34]
웹사이트
水道水の浄化に使われたアルミニウムの挙動を追う
https://www.kobe-u.a[...]
2022-03-15
[35]
웹사이트
アルミ系凝集剤(PAC・硫酸バンド)
https://www.hiyoshi-[...]
2024-08-05
[36]
논문
Aluminum-induced neurotoxicity: alterations in membrane function at the blood–brain barrier.
http://www.sciencedi[...]
1989-04
[37]
논문
Cholinergic and noradrenergic toxicity of intraventricular aluminum chloride in the rat hippocampus.
http://www.sciencedi[...]
1989-10
[38]
논문
Aluminum-induced acute cholinergic neurotoxicity in rat.
https://link.springe[...]
1992-08
[39]
논문
A morphological analysis of the motor neuron degeneration and microglial reaction in acute and chronic in vivo aluminum chloride neurotoxicity.
http://www.sciencedi[...]
2000-01
[40]
웹사이트
安全かつ有効なアジュバントの研究開発と将来の応用分野
https://medical.nikk[...]
メディカル日経BP
2016-09-11
[41]
논문
Guidelines of care for the management of acne vulgaris.
http://www.jaad.org/[...]
2016-05
[42]
PDF
マルホ皮膚科セミナー(2017年11月16日放送)
http://medical.radio[...]
ラジオ日経
[43]
PDF
原発性局所多汗症診療ガイドライン 2015 年改訂版
https://www.dermatol[...]
日本皮膚科学会ガイドライン
[44]
서적
RubberBible92nd
[45]
웹사이트
Aluminum chloride
http://chemister.ru/[...]
Chemister.ru
2014-05-05
[46]
저널
Die Kristallstruktur der Aluminiumhalogenide II
[47]
서적
RubberBible92nd
[48]
웹사이트
Sigma-Aldrich
2014-05-05
[49]
간행물
PGCH
[50]
서적
Aluminum Compounds, Inorganic
Ullmann
[51]
웹사이트
Aluminum Chloride
https://web.archive.[...]
solvaychemicals.us
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
![염화 알루미늄 6수화물, 순수 (위), [[염화 철(III)]]로 오염 (아래)](https://cdn.onul.works/wiki/noimage.png)